Las mitocondrias son organelos
en forma de bastón que abundan en la mayoría de las células debido a una de las
muchas funciones que llevan a cabo que es vital para la misma, la cual es la
producción de energía a través de varios procesos y vías metabólicas que se
llevan en su interior como, por ejemplo: la fosforilación oxidativa, ciclo de
Krebs, β-oxidación, etc. Además de la producción de energía en forma de ATP y
otras moléculas almacenadoras de energía, también participa en la generación de
calor, y los primeros pasos de la gluconeogénesis, la β-Reducción, la
cetogénesis entre otros.
Las mitocondrias cuentan con
una membrana externa lisa y otra interna la cual está plegada, los pliegues de
la membrana interna son denominados crestas incrementan el área superficial de esa
membrana. El espacio entre ambas membranas se define como el espacio
intermembrana, mientras que el espacio delimitado por la membrana interna se
denomina matriz.
 |
| Esquema de una Mitocondria |
 |
| Mitocondria vista con microscopio electronico de transmisión |
Membrana Mitocondrial Externa
y Espacio Intermembrana
La membrana interna es lisa,
recubre toda la mitocondria, en ella se encuentran varias proteínas transmembrana
denominadas porinas que permiten el paso de moléculas hidrosolubles pequeñas,
razón por la cual el contenido del espacio intermembrana es muy parecido al del
citoplasma. Además, hay otras proteínas responsables de la síntesis de lípidos
mitocondriales en la misma.
Membrana Mitocondrial Interna
A diferencia de la externa
está se encuentra plegada en crestas para aumentar su área superficial,
delimita el espacio de la matriz. Esta formada principalmente por cardiolipina
un fosfolípido que a diferencia de cualquier otro posee cuatro cadenas de
ácidos grasos en ves de dos, razón por lo que está membrana es casi impermeable
a iones, electrones y protones.
En algunas partes las
membranas externas e interna están en contacto. Estas zonas se denominan puntos
de contacto, que actúan a modo de vías para la entrada y salida de proteínas y
moléculas pequeñas de la matriz. Los puntos de contacto están compuestos de
proteínas transportadoras para el acarreo y proteínas reguladoras para el
reconocimiento de marcadores y transporte de macromoléculas concretas.
En otros puntos también se da
el transporte de macromoléculas hacia la membrana interna, externa o la matriz,
solo que en estos no se juntan las membranas, pero poseen moléculas receptoras
capaces de reconocer la macromolécula transportada como las portadoras
citoplasmáticas que llevan la macromolécula en concreto.
Para que las proteínas
destinadas a la mitocondria puedan entrar necesitan tener dos señales, la
primera es una secuencia de aminoácidos con carga positiva en su extremo
inicial y la proteína de choque térmico 70, La translocasa de la membrana
mitocondrial externa reconoce ambas señales y transporta la proteína al
compartimiento intermembrana. Otra proteína ubicada en la membrana interna, la
translocasa de la membrana mitocondrial interna transloca la proteína del
espacio intermembrana a la matriz para luego disociar a la proteína de choque
térmico 70 y a la secuencia de aminoácidos.
Otros elementos que
encontramos en la misma son proteínas que vistas al microscopio electrónico se
asemejan a una paleta de pirulí, las ATP sintasas responsables de la síntesis
de ATP, y las Cadenas de transporte de electrones que aportan la energía para
la ATP sintasa, también encontramos proteínas de intercambio de ADP/ATP que
introducen ADP y sacan ATP de la mitocondria. De estos procesos hablaremos más
adelante.
Matriz
La matriz está conformada por
un liquido denso rico en proteínas que contiene las enzimas necesarias para la
conversión del piruvato en Acetil-CoA, la β-oxidación y el ciclo de Krebs
(procesos que veremos más adelantes). Otras cosas que podemos encontrar en la
matriz ribosomas, ARNt, ARNm, y sobre todo su propio ADN y las enzimas
necesarias para su expresión. También podemos encontrar los granulos de la
matriz compuestos por fosfolipoproteínas, calcio y magnesio, su función aun no
se conoce, pero se cree que secuestran calcio para evitar la toxicidad del
mismo.
Vías Metabólicas y Procesos
Mitocondriales
Como mencionamos al inicio la
principal tarea de la mitocondria es el suministro de energía para las
actividades de la célula, esto lo consigue a través del proceso de
fosforilación oxidativa (o síntesis de ATP), pero también por otros procesos
metabólicos tanto cíclicos como catabólicos, como es el caso del ciclo de
Krebs, la β-oxidación y la Cetogénesis. A continuación, describiremos
brevemente estos procesos, si el lector desea saber más información al respecto
puede consultar cualquier libro o sitio dedicado a la bioquímica.
Eje Metabólico Central
Antes de explicar los procesos
metabólicos de la mitocondria aclararemos algunos conceptos, entre ellos
Metabolismo, Catabolismo, Anabolismo y el eje metabólico central: el
metabolismo es el conjunto de reacciones químicas y vías que cooperan para la
obtención de energía a través de la degradación de moléculas del ambiente o
bien para la síntesis de moléculas con funciones especializadas. El catabolismo
consiste en la degradación de moléculas grandes a moléculas pequeñas con la
subsiguiente liberación de energía. El Anabolismo consiste en la Creación de
moléculas grandes a partir de pequeñas con el consumo de energía. Todos estos
procesos se rigen por vías metabólicas que pueden ser catabólicas, anabólicas o
cíclicas.
El eje metabólico central es
el conjunto de vías metabólicas cuyos productos se conectan a otras vías a las
que les sirven como sustrato, y viceversa, es decir en otros casos los
productos de otras vías se conectan al eje para servir como sustratos. Las vías
y procesos que forman parte del eje son: la Glucolisis, La descarboxilación
Oxidativa del Piruvato, El ciclo de Krebs, La cadena de transporte de
electrones y La Fosforilación Oxidativa. La glucolisis es una vía del
metabolismo de carbohidratos que sucede en el citoplasma donde una molécula de glucosa
se convierte en 2 piruvatos y libera 2 ATP, al ser una vía citoplasmática nos
limitaremos a resumirla con el siguiente esquema, por otra parte, el resto de
procesos del eje suceden en la mitocondria por lo que los trataremos con un
poco mas de detalle
 |
| Eje Metabolico Central |
Descarboxilación Oxidativa del
Piruvato
El piruvato producido por la
glucolisis, será convertido en Acetil-CoA, dicho proceso llevado por la
mitocondria y catalizado por el complejo multienzimatico denominado Piruvato
Deshidrogenasa que consta del funcionamiento acoplado de tres enzimas: la
carboxilasa, la transacetilasa y la deshidrogenasa, con la intervención de
cinco coenzimas: TPP, Lipoato, CoA, FAD y NAD. El resultado final del
proceso es la producción de Acetil-CoA, y la liberación de CO2 y
NADH.
La primer enzima E1.
También conocida como carboxilasa, en muchas ocasiones mal llamada
piruvato deshidrogenasa, lo cual es un error ya que no actúa como
deshidrogenasa sino como descarboxilasa. Está enzima actúa con su coenzima Tiamina
Pirofosfato (TPP), un derivado de la vitamina B1. La enzima E1
descarboxila al piruvato desprendiendo CO2 y dejando al resto del
mismo (Resto de Hidroxietilo) unido al TPP.
La enzima E2 o
Transacetilasa es la enzima central del complejo por un lado recibe al
resto de Hidroxietilo del TPP. Está enzima tiene un “brazo” formado por
ácido lipoico el cual está unido a el resto de la enzima, dicho brazo es el
encargado de tomar el resto de Hidroxietilo de la TPP, para luego entregarlo a
la Coenzima A (CoA) para formar la Acetil-CoA.
La ultima enzima del proceso,
la E3 o Deshidrogenasa, no participa directamente en la formación de la
Acetil-CoA, pero ayuda a regresar a E2 a su forma original y a formar NADH
de forma indirecta. Cuando el resto de Hidroxietilo es entregado a la CoA,
el brazo de la enzima E2 se queda con grupos tiol (-SH), de los cuales entrega los
hidrógenos al grupo prostético de la E3 que es el FAD, y de está manera se
forma FADH, luego este entrega los hidrógenos al NAD que se vuelve NADH
quien después entrega los hidrógenos al complejo I de la cadena de transporte
de electrones de quien hablaremos más adelante.
 |
| Descarboxilación Oxidativa del Piruvato |
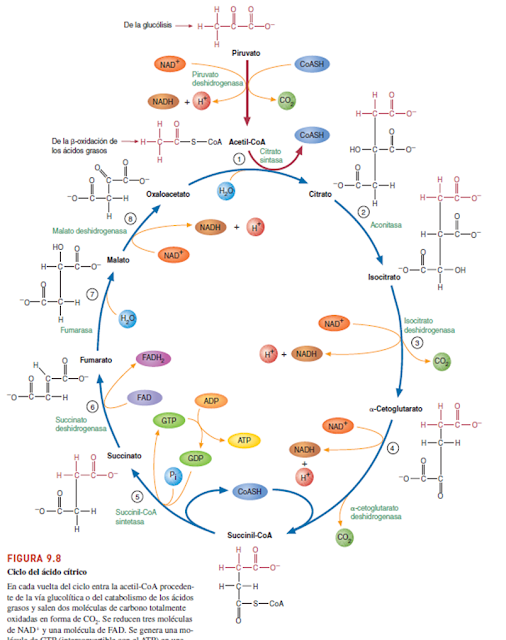
Ciclo de Krebs
También conocido como ciclo de
los ácidos tricarboxilicos o ciclo del ácido cítrico, es una vía metabólica
cíclica que sucede en la matriz mitocondrial, en la que se oxida la porción acetato
de la Acetil-CoA hasta CO2, H2O, 4 pares de hidrógenos
que alimentan la cadena de transporte de electrones a través del NADH, y el
FADH.
Reacciones del Ciclo
·
Primero se va a condensar el Acetil-CoA
y el Oxalacetato para formar Citrato por la Enzima Citrato Sintasa
·
El Citrato se vuelve Isocitrato
por acción de la enzima Aconitasa
·
Luego el Isocitrato se vuelve α-Cetoglutarato
por la enzima Isocitrato Deshidrogenasa, en el proceso se libera CO2
y NADH
·
El α-Cetoglutarato se convierte en Succinil-CoA
por la enzima α-Cetoglutarato Deshidrogenasa, en el proceso se libera
NADH y una Coenzima A entra para formar una Succinil-CoA y el residuo sale como
CO2
·
El Succinil-CoA se vuelve Succinato
por la enzima Succinil-CoA Sintetasa, en el proceso se libera una CoA y
un GTP
·
Luego el Succinato pasa a ser Fumarato
por la enzima Succinato Deshidrogenasa, en el proceso se libera FADH, mismo
que será enviado al complejo II de la cadena de transporte de electrones,
por ello se dice que el ciclo de Krebs y la cadena de transporte de electrones
se conectan aquí
·
Después el Fumarato pasa a ser Malato
gracias a la enzima Fumarasa
·
Luego el Malato se convierte en Oxalacetato
por la enzima Malato Deshidrogenasa, y así este se vuelve a condensar
con Acetil-CoA para volver a formar citrato repitiéndose de nuevo el ciclo, en
el proceso se forma de nuevo NADH
Además, los productos que se
producen a lo largo del ciclo sirven como sustratos para otras vías que se
describen a continuación en el siguiente esquema.
 |
| Destino de los productos del ciclo de krebs |
También los productos de otras
vías se incorporan al ciclo, como lo muestra la siguiente imagen.
 |
| Incorporación de productos a otras vias al ciclo de Krebs |
Correlación Clínica Encefalopatía y Canceres Asociados al Ciclo de Krebs
Hay enfermedades que se han atribuido a deficiencias en las enzimas del
ciclo del ácido cítrico. Debido a las altas necesidades de energía del cerebro,
las enfermedades observadas suelen ser formas de encefalopatía (disfunción
cerebral caracterizada por deficiencias cognitivas, temblor y convulsiones). Por
ejemplo, las encefalopatías se relacionan con mutaciones en los genes que codifican
la α-Cetoglutarato Deshidrogenasa, Succinato deshidrogenasa, Fumarasa y Succinil-CoA
sintetasa.
Varios cánceres raros también se producen por deficiencias enzimáticas en
el ciclo del ácido cítrico. Una forma de cáncer de células renales se origina
por mutaciones en la Fumarasa.
Cadena de Transporte de
Electrones
La Cadena de transporte de
electrones es un conjunto de acarreadores de electrones, situada en la membrana
interna, dichos electrones provienen de las coenzimas reducidas al oxígeno. La
energía que se libera durante la transferencia de electrones se acopla a varios
procesos endergónicos, de los que el más importante es la síntesis de ATP, pero
también a el bombeo de Ca2+ al interior de la matriz mitocondrial y la
generación de calor en el tejido adiposo marrón.
Componentes de la Cadena de
Transporte de Electrones
Complejo I
El complejo I también
llamado NADH Deshidrogenasa cataliza la transferencia de electrones del
NADH a la Ubiquinona. El complejo está compuesto por una molécula de Mononucleótido
de Flavina (FMN) y 7 Centros Hierro-Azufre que son intermediarios en
la transferencia de un solo electrón. Primero la NADH reduce al FMN a
FMNH al pasarle sus H+, Luego el FMNH2 le da sus electrones a
los Centros Hierro-Azufre DE UNO EN UNO, los cuales luego se pasan a la
Ubiquinona un transportados de electrones capaz de aceptar y donar electrones
DE UNO EN UNO.
Complejo II
El complejo II o Succinato
Deshidrogenasa consta de 4 subunidades proteicas que son: ShdA una
flavoproteína con un sitio de unión para el succinato y un FAD unido por un
enlace covalente al mismo, ShdB una ferrosulfoproteína con 3 Centros
Hierro-Azufre, ShdC, y ShdD son solo proteínas estructurales. El sitio
de unión a la Ubiquinona está formado entre ShdC y ShdD, a su vez el
dímero actúa como un sitio de unión al grupo hemo el cual evita la fuga
electrónica en el complejo para que no se formen radicales de oxígeno. El
complejo II media la transferencia de electrones del succinato a la Ubiquinona.
Después de la reducción del FAD en el ciclo de Krebs, los electrones son
transferidos por los centros hierro azufre para después pasar a la ubiquinona.
Complejo III
El complejo III también
llamado Complejo del Citocromo BCI es un dímero donde cada
monómero posee 11 subunidades entre las cuales encontramos a los citocromos Cit-bL,
Cit-bH y Cit-cI, y un Centro Hierro-Azufre.
Los citocromos son proteínas transportadoras de electrones que contienen un
grupo hemo, los cuales son transportados uno a la ves en asociación a un cambio
reversible de oxidación en el grupo hemo. La función de del complejo III es
transportar los electrones de la ubiquinona reducida al citocromo c, que es un
transportador libre de electrones
Ciclo Q
El transporte de electrones
por el complejo III es conocido como el ciclo Q, en el proceso las ubiquinonas
se difunden entre los donadores de los complejos I y II y el aceptor ósea el
complejo III. La ubiquinona dona sus electrones, UNO A LA VEZ, uno primero se
desplaza al Cit-cI, y luego al citocromo c, los
productos de esta transferencia son Ubiquinona y dos protones de Ubiquinona
reducida que son transferidos al espacio intermembrana luego la ubiquinona pasa
su segundo electrón, pero al Cit-bL y luego al Cit-bH. El
producto de la primera etapa en el ciclo Q es UQ, con la transferencia de un
electrón al citocromo c, un segundo electrón al Cit-bH; dos protones
transferidos al espacio intermembrana. La segunda etapa del ciclo involucra otra
ubiquinona reducida que transfiere un electrón al citocromo c de la misma forma
que en la primer etapa, luego, el producto Ubiquinona acepta el electrón de Cit-bH
y dos protones de la matriz mitocondrial para formar Ubiquinona Reducida. El efecto
neto es que dos electrones y cuatro protones alimentan el espacio intermembrana
del lado de la membrana interna para oxidar el citocromo c y contribuir al
gradiente de protones. Se forman una molécula de Ubiquinona y una de Ubiquinona
Reducida dentro de la membrana con dos protones aportados por la matriz
mitocondrial.
Complejo IV
También llamado citocromo
oxidasa es un complejo proteínico que cataliza la reducción de 4
electrones de O2 para formar H2O, El complejo IV
contiene los citocromos a y a3 y tres iones cobre. Dos de éstos forman CuA/CuA,
un centro binuclear Cu-Cu; el hemo a3 y el CuB forman un centro
binuclear Fe-Cu. Ambos centros aceptan electrones, uno a la vez. Los
electrones fluyen del citocromo c al CuA/CuA, luego al citocromo a, de aquí a
a3-CuB y por último a O2. Cuatro protones y cuatro electrones son impulsados a
través del complejo IV desde la cara externa de la membrana mitocondrial
interna hasta la matriz para su entrega al dioxígeno unido al citocromo
a3-Fe(II). Se forman dos moléculas de agua, que salen del sitio.
En el complejo IV y el citocromo
c hay sitios de unión de ATP reguladores. Cuando la concentración de ATP es
alta, el ATP actúa como inhibidor alostérico, se une a estos sitios y causa un
decremento en la actividad del transporte de electrones.
La oxidación del NADH resulta
en la liberación de una cantidad sustancial de energía, determinada por un
decremento en los potenciales de reducción (ΔE°′), en la medida en que los
electrones fluyen por los complejos I, III y IV. Se sintetizan aproximadamente
2.5 moléculas de ATP por cada par de electrones que se transfieren entre el
NADH y el O2 en la cadena de transporte de electrones. De la transferencia de
cada par donado por el FADH que se produce en la oxidación del succinato
resultan alrededor de 1.5 moléculas de ATP.
 |
| Cadena de Transporte de Electrones |
Fosforilación Oxidativa
La fosforilación oxidativa,
proceso en el que la energía generada mediante la cadena de transporte de electrones
se conserva por la fosforilación del ADP para producir ATP, por medio del
complejo ATP sintasa.
Teoría Quimiosmótica
La teoría quimiosmótica fue
propuesta por Peter Mitchell en 1961, explica que al pasar los electrones a
través de la cadena de transporte de electrones se transportan protones desde
la matriz y se liberan en el espacio intermembrana. Como consecuencia, se crea
un potencial eléctrico y un gradiente de protones (o ΔpH) a través de la membrana
interna. El gradiente electroquímico de protones se denomina algunas veces como
la fuerza protón motriz, y es el encargado de impulsar la síntesis del ATP. El
ATP se sintetiza a partir de ADP y Pi (Pirofosfato libre) la ATP sintasa también
se conoce como complejo V de la cadena de transporte de electrones, el cual
contiene un canal de protones. La síntesis de ATP se produce como resultado de
las condiciones termodinámicas favorables que produce el flujo de protones a
través del canal.
ATP Sintasa y Síntesis de ATP
La ATP sintasa es un compuesto
enzimático responsable de la síntesis de ATP, visto al microscopio electrónico
parece tener la forma de una paleta de pirulí, está compuesto por dos unidades F1
y F0, La primera es la ATPasa activa que está compuesta por las
subunidades: α (3), β (3), γ, δ y ε, y la segunda es un canal de
protones compuesto por las subunidades: a, b (2) y c (10-12).
 |
| ATP Sintasa |
 |
| ATP Sintasa vista con Microscopio Electronico de Transmisión |
La ATP sintasa consta de dos
motores giratorios unidos entre sí por un componente estacionario de un motor.
el motor F0 convierte la fuerza protón motriz en una fuerza
rotatoria que impulsa la síntesis de ATP catalizada por la unidad F1.
El componente giratorio, el anillo c (formado a partir de las subunidades c),
que está unido a un eje central constituido por las subunidades ε y γ, gira
dentro del hexámero α. Β de la unidad F1. El componente estacionario (las
subunidades b y δ) impide que el hexámero gire.
La síntesis de cada ATP
requiere de translocar tres protones a través de la ATP sintasa. (Se requiere
la transferencia de otro protón para el transporte de ATP y de OH− fuera de la
matriz a cambio de ADP y de Pi.) Cuando los protones fluyen por la F0,
la rotación del conducto de protones (c12, también llamado anillo c) se
transmite a la subunidad γ que se proyecta en el núcleo de la unidad F1.
La rotación del eje central lo coloca en tres posiciones posibles respecto a
cada dímero α, β. La fuerza protón motriz induce tres rotaciones secuenciales
de 120° del hexámero α, β. Conforme procede la rotación, cada uno de los tres
sitios de unión a nucleótidos experimenta una serie de cambios conformacionales
que dan por resultado la síntesis de ATP.
El mecanismo de la síntesis de
ATP mediante la ATP sintasa es el siguiente. En la unidad F0 cada
subunidad c del anillo c consta de dos hélices transmembrana antiparalelas. La
hélice del C-terminal de las subunidades c contiene un residuo esencial de
aspartato (Asp) que con la protonación causa un movimiento giratorio, el cual a
su vez induce la rotación de toda la subunidad. La deprotonación de este
residuo hace que la hélice del C-terminal vuelva a su conformación original.
Los protones entran en el anillo c a través de un canal en la subunidad α. Al
final de este canal, en la interfaz de la subunidad α y la subunidad proximal
c, un residuo básico de arginina (Arg) transfiere el protón entrante al residuo
de Asp en la subunidad c. Como resultado de la rotación de la subunidad c, se
desplaza de la subunidad α. Cuando el siguiente protón pasa por el canal de la
subunidad α, el proceso se repite. El efecto neto es la rotación del anillo c
en sentido contrario al de las manecillas del reloj. La fuerza de torsión generada
por la rotación de la subunidad c hace que el eje central asimétrico
(constituido por las subunidades ε y γ) gire en una camisa dentro del hexámero α,
β.
Los sitios catalíticos del hexámero α, β están
en las subunidades β. Se encuentran en tres conformaciones en términos de
afinidad por los ligandos de nucleótido de adenina: abierta (O) (inactiva con
baja afinidad), apretada (T) (activa con alta afinidad) y laxa (L) (también inactiva).
La Interconversión entre estas conformaciones es causada por interacción con la
subunidad γ giratoria.
Ocurren básicamente tres pasos en el proceso de
síntesis de ATP:
·
ADP y Pi se unen a un sitio L,
·
Se sintetiza ATP cuando la conformación L se
transforma en una T,
·
Se libera ATP cuando la conformación T se
convierte en O. Conforme la subunidad γ gira e interactúa de manera secuencial con
cada subunidad β, cada sitio activo es forzado a pasar por las conformaciones O,
T y L.
 |
| Sintesis de ATP |
Correlación Clínica: Intoxicación por Dinitrofenol
Durante la década de 1930 se comercializó un compuesto llamado
2,4-dinitrofenol, el cual se anunciaba como un “producto milagro” para bajar de
peso con una pequeña peculiaridad, SI FUNCIONABA, ya que esta sustancia es un
desacoplante de la fosforilación oxidativa, eso quiere decir que separaba el
proceso de la fosforilación oxidativa de la cadena de transporte de electrones
al colapsar el gradiente de protones e igualar sus concentraciones a ambos
lados de la membrana interna con lo que se detiene la síntesis de ATP, pero no
la cadena de transporte de electrones. De está manera los alimentos consumidos
no son utilizados para producir ATP, sino que se disipan como calor, dando lugar
a la perdida de peso, sin embargo, todo lo que se busca por el camino fácil
tiene sus consecuencias y el consumo de Dinitrofenol no es la excepción, ya que
son requeridas dosis muy pequeñas para que se bloquee la fosforilación
oxidativa a tal grado de llegar a concentraciones tan bajas de ATP que resultan
incompatibles con la vida. La principal causa de muerte por consumo de
Dinitrofenol es la insuficiencia hepática, puesto que el hepatocito requiere un
aporte energético alto para la gran cantidad de funciones que realiza, Los
signos y síntomas más comunes de la intoxicación por Dinitrofenol son: Hipertermia,
Taquicardia, Sudoración, Cefalea, Convulsiones y Debilidad. Aunque el uso del
Dinitrofenol como suplemento alimenticio fue prohibido desde 1938
desgraciadamente aún es vendido como tal en varios sitios de internet.
β Oxidación
La β Oxidación es el proceso
por el cual los ácidos grasos pares y saturados se degradan por la separación
secuencial de fragmentos de 2 carbonos desde el extremo carboxilo, durante el
proceso se oxida el carbono β y se libera Acetil-CoA, al romperse el enlace entre
los carbonos α y β. Dicho proceso se repite hasta que todo el ácido graso es
consumido.
Para que inicie el proceso los
ácidos grasos deben activarse mediante la reacción con ATP y CoA por la
enzima Acil-CoA Sintetasa que está en la membrana externa formando así
Acil-CoA. Para la siguiente fase la Acil-CoA debe entrar a la matriz, pero es
impermeable a la membrana interna, así que para poder entrar se une a un
transportador llamado carnitina en los siguientes pasos:
·
La Acil-CoA se vuelve Acilcarnitina
al pegarse a una molécula de carnitina por la enzima aciltransferasa
de carnitina I (CAT I)
·
Una proteína de la membrana interna transfiere
la Acilcarnitina a la matriz
·
La Acilcarnitina una vez dentro se
convierte nuevamente en Acil-CoA por la enzima aciltransferasa de
carnitina II (CAT II)
·
La Carnitina es devuelta a su posición original
 |
| Activación y Transporte de Ácidos Grasos |
Una ves dentro la Acil-CoA
puede proceder a la β Oxidación, que consiste en los siguientes pasos
·
La Acil-CoA se vuelve Trans-α, β-Enoil-CoA
por la Acil-CoA Deshidrogenasa, en el procesos se produce un FADH
·
La Trans-α, β-Enoil-CoA se hace L-β-Hidroxiacil-CoA
por la enzima Enoil-CoA Hidratasa
·
El L-β-Hidroxiacil-CoA se vuelve β-Cetoacil-CoA
por la β-Hidroxiacil-CoA Deshidrogenasa, en el proceso sale un NADH
·
El β-Cetoacil-CoA por acción de la
enzima Tiolasa forma Acetil-CoA y Acil-CoA con 2 carbonos menos.
 |
| Proceso de beta oxidación |
El proceso se repite hasta que
la molécula le quedan cuatro carbonos que luego se fragmentan en 2 Acetil-CoA. que
se enviaran al ciclo de Krebs
Cetogénesis
La Acetil-CoA formada en el
metabolismo de los ácidos grasos entra al ciclo de Krebs y el excedente se usa
para la formación de cuerpos cetónicos, dicho proceso sucede en la matriz
mitocondrial de las mitocondrias hepáticas a través de las siguientes
reacciones.
·
Se unen dos moléculas de Acetil-CoA para
formar Acetoacil-CoA por la enzima Acetoacil-CoA Tiolasa, sale
CoA en el proceso.
·
La Acetoacil-CoA se une con otra Acetil-CoA
para formar Hidroximetilglutaril-CoA (HMG-CoA) gracias a la enzima HMG-CoA
Sintasa, en la reacción sale CoA
·
La HMG-CoA se fracciona y forma Acetoacetato
y Acetil-CoA gracias a la HGM-CoA Liasa.
·
El Acetoacetato se reduce para formar se
reduce para formar β-Hidroxibutirato. La Acetona se forma por descarboxilación
del acetoacetato cuando la concentración de este es elevada.
Los cuerpos cetónicos son
utilizados como energía al ser convertidos de nuevo en Acetil-CoA en tejidos
como el musculo esquelético, musculo cardiaco y cerebro ya que todas las
reacciones descritas antes son reversibles.
Correlación Clínica Cetoacidosis Diabética
La cetosis, se produce durante la inanición y en la diabetes no
controlada, una enfermedad metabólica. En ambos trastornos el suministro de
energía depende, en gran medida, de las reservas de grasas y de la β-oxidación
de los ácidos grasos. Ya que no es utilizada la energía de los carbohidratos, los
cuerpos cetónicos al ser compuestos por ácidos carboxílicos y cetonas dan pauta
a la disminución del pH, por lo que al acumularse pueden ser tóxicos.
Ciclo de la Urea
El ciclo de la urea es una vía
donde se procesan los derivados del catabolismo de proteínas y se genera urea
como producto final para la eliminación del nitrógeno sobrante del catabolismo
de proteínas
El ciclo consta de las
siguientes reacciones:
·
NH4+ HCO3- se
juntan para formar Fosfato de Carbamoilo por la enzima Carbamoilo
Sintasa, el proceso requiere de 2 ATP. Esto sucede en la mitocondria
·
El Fosfato
de Carbamoilo reacciona con Ornitina para formar Citrulina
por la enzima Transcarbomoilasa de Ornitina, en el proceso sale
pirofosfato. Esto se lleva en la mitocondria
·
Después
la Citrulina se lleva al citoplasma para que se vuelva Arginosuccinato
al reaccionar con aspartato por la enzima Arginosuccinato Sintasa
·
El Arginosuccinato se vuelve Fumarato (Que volverá
a la mitocondria para ser introducido en el ciclo de Krebs) y Arginina que será
el precursor de la urea, esto se lleva a cabo por la enzima Arginosuccinato
Liasa.
·
Para finalizar la Arginina se hidroliza a
Ornitina y Urea por la enzima Arginasa
 |
| Ciclo de la Urea |
Una vez formada la urea por el
hepatocito esta sale al torrente sanguíneo y luego llega al riñón donde será
expulsada por la orina.
El ciclo de Krebs y el ciclo
de la urea están doblemente conectados ya que por una parte el aspartato
requerido en el ciclo de la urea sale del ciclo de Krebs y luego el fumarato
regresa al mismo.
Teoría de la Endosimbiosis de
Lynn Margulis
La teoría de la endosimbiosis
fue propuesta por Lynn Margulis en 1967, la cual explica el origen simbiogenético
de las células eucariotas, y con ello el origen de organelos como la mitocondria
y el cloroplasto como procariotas de vida libre similares a las bacterias. La teoría
dice que las mitocondrias eran organismos procariotas que fueron fagocitados
por una célula, pero está no los digirió, sino al contrario está los acoplo de
tal manera que establecieron una relación con la célula que las devoro, que si
se piensa bien es un trato justo ya que la mitocondria provee de energía a la
célula hospedera y esta a su ves le ofrece a cambio protección y alojamiento
del exterior.
| Teoria de la endosimbiosis |
En resumen, la mitocondria es
un organelo que es necesario para que la célula pueda llevar a cabo todas sus
funciones, además de su interesante origen. En nuestra siguiente entrega hablaremos
del citoesqueleto.
Fuentes
Gartner, Leslie P. Texto De Histología Atlas a Color. 4 ed., Elsevier, 2017
McKee, Trudy et al. Bioquímica Las Bases Moleculares De La Vida. 5 ed., Mcgraw-Hill Interamericana, 2014.
Nelson, David L et al. Lehninger Principios De Bioquímica. 5 ed., Omega, 2015.


No hay comentarios.:
Publicar un comentario