En entregas pasadas hemos
aprendido acerca de la estructura y función de la célula, pero nunca hablamos
de las técnicas de estudio de la misma, es decir nunca hablamos acerca de lo
que esperaríamos ver bajo el microscopio, o como se verían aquellas células y
organelos de los que tanto hemos hablado a lo largo de este blog, o bajo que
procesos pasaron, por lo que hoy nos daremos a la tarea de analizar de manera
general los procesos a los que son sometidos los tejidos para poder ser
estudiados bajo el microscopio, a lo que denominamos Técnica Histológica.
Se denomina Técnica Histológica
al conjunto de procedimientos aplicados a un material biológico (animal o
vegetal) con la finalidad de prepararlo y conferirle las condiciones óptimas
para poder observar, examinar y analizar sus componentes morfológicos a través
de los microscopios fotónicos y electrónicos. La técnica histológica consta de los
siguientes pasos: Toma de la Muestra, Fijación, Inclusión, Microtomia y
Tinción. Los procesos realizados y los materiales empleados en cada paso varían
de acuerdo al tejido que se procesara y a lo que se quiere observar en el
mismo, por lo que aquí hablaremos únicamente de la técnica de procesamiento de
tejidos en parafina, y luego subiremos más técnicas como la criofractura o la
hibridación in situ.
Toma de la Muestra
La toma de la muestra puede ser
por necropsia cuando está se toma de un organismo muerto o por biopsia cuando
la muestra procede de un organismo vivo. La biopsia puede ser:
·
Citología Exfoliativa (raspado): Cuando se
toman células que se descaman fácilmente de superficies corporales.
·
Insicional: Cuando se toma con instrumental
quirúrgico una parte de tejido sano y otra de tejido enfermo.
·
Exicional: Cuando se toma todo el tejido
lesionado
·
Punción: Se hace en órganos solidos con una
aguja que se clava en el área de lesión
·
Aspiración: El aspirado se realiza en lesiones
quísticas.
 |
| Aguja para biopsia insicional |
Fijación
La fijación es un proceso que
tiene como objetivo detener la vida de las células e impedir las modificaciones
post mortem que pueda sufrir la célula (procesos autolíticos), manteniendo la
estructura morfológica de células y tejidos sin que ocurran cambios notables en
ellos. La fijación puede ser física por congelación o química empleando
sustancias como el formaldehido. Los fijadores químicos se pueden dividir en
reductores y oxidantes
·
Oxidantes: tetraóxido de osmio (ácido ósmico),
bicromato de potasio, ácido crómico, bicloruro de mercurio o “sublimado
corrosivo”, ácido pícrico, ácido acético.
·
Reductores: formaldehído, glutaraldehído,
alcohol etílico, alcohol metílico
La acción oxidante o reductora
de los fijadores le confieren a las células ciertas condiciones que posibilitan
una mejor aplicación de las sustancias colorantes, por ejemplo: el alcohol
etílico conserva el glucógeno, el bicloruro de mercurio provoca que las
anilinas coloreen de manera más brillante a las fibras colágenas, el bicromato
de potasio facilita la coloración de las mitocondrias, el ácido acético permite
una mejor tinción de los núcleos, el cloruro de calcio conserva e insolubiliza
parcialmente a los lípidos.
El fijador químico más
utilizado es el formaldehído. El formaldehido es un gas que se presenta para su
uso diluido al 37 % en agua, y esta dilución se le denomina formol o formalina.
Para la fijación las muestras se sumergen en formol al 10% en agua
.
Inclusión
Los tejidos fijados adquieren
cierta consistencia y dureza, pero no la suficiente para que, de ellos, se
obtengan secciones delgadas. Estas secciones, del orden de algunas milésimas de
milímetro (5 a 10 μm), se conseguirán cuando los tejidos se infiltren con
sustancias denominadas “de inclusión” y adquieran tal dureza que sometidos al
filo de una navaja produzcan secciones, cortes o láminas sumamente delgados y
transparentes.
Existen una serie de
sustancias de inclusión que se utilizan actualmente. Unas son solubles en agua
(gelatina, carbowax, glicol metacrilato) otras, solubles en solventes orgánicos
(parafina, celoidina, resinas epóxicas). De ellas una de las más utilizadas es
la parafina.
Cualquiera que sea el medio de
inclusión a emplear es indispensable que la muestra a incluir se encuentre
embebida en la sustancia que disuelve al medio de inclusión. Después de la
fijación de las muestras, éstas se encuentran embebidas en agua o en alcohol,
por lo que resulta imposible que se infiltren con parafina, ya que es insoluble
en agua y alcohol. Por lo tanto, para que los tejidos puedan ser incluidos en
parafina se requiere Extraer el fijador, Deshidratarlos e Infiltrarlos con el
solvente de la sustancia de inclusión. Los pasos a seguir para la inclusión de
las muestras en parafina son: Extracción del fijador, Deshidratación,
Diafanización, Infiltración e Inclusión
Extracción del Fijador
Se lava la muestra con agua
para extraer el fijador
Deshidratación
Significa extraer o remover el
agua de los tejidos fijados. Se sumerge la muestra en baños de etanol comenzando
por concentraciones bajas hasta llegar a etanol absoluto. La deshidratación
debe ser completa porque, de lo contrario, el solvente no actúa de forma
adecuada y el bloque de inclusión no alcanza la dureza requerida. Los baños en
alcohol etílico se realizan de la siguiente manera:
1.
alcohol etílico al 70 % por 12 horas
2.
alcohol etílico al 70 % por 12 horas
3.
alcohol etílico al 95 % por 1 hora
4.
alcohol etílico al 95 % por 1 hora
5.
alcohol etílico al 100% por 1 hora
6.
alcohol
etílico al 100 % por 1 a 1.5 horas.
También
puede usarse para este proceso: el alcohol isopropílico, el dioxano y el
cloroformo.
Diafanización
Las muestras deshidratadas se
encuentran embebidas en alcohol etílico absoluto; al cual la parafina tampoco
es soluble, por lo que es necesario reemplazarlo por sustancias que sean
capaces, de mezclarse con el alcohol y disolver la parafina. La sustancia más
usada es el Xilol, en el cual se sumerge la muestra en baños de la siguiente
manera:
1.
alcohol absoluto (50%) xilol (50%) por 1 hora
2.
xilol por 1 hora,
3.
xilol por 1 hora.
También se puede usar: tolueno, benceno, y el cloroformo.
Infiltración
Se sumerge la muestra en
parafina líquida en tres baños:
1.
1 a 1.5 horas,
2.
1 a 1.5 horas,
3.
30 a 60 minutos
Inclusión
Se sumerge la muestra
infiltrada en un molde lleno de parafina líquida y se deja enfriar. La muestra
queda incluida en un bloque de parafina.
 |
| Bloques de Parafina |
Microtomia
El bloque de parafina se
coloca en un microtomo, en el microtomo el bloque se desliza por una cuchilla
de acero y así se obtiene el corte de la muestra. Los cortes luego se extienden
en un baño de flotación con agua caliente y se recogen en un portaobjetos
 |
| Microtomo |
Tinción e Histoquímica
Los portaobjetos en los que
están adheridos los cortes infiltrados en parafina se sumergen en diferentes
líquidos para realizar la tinción y completar la preparación de la muestra.
Dependiendo de el colorante a elegir seguirán una serie de pasos y
procedimientos diferentes, aunque la mayoría de las tinciones emplea la
siguiente secuencia:
1.
Desparafinación: Se realiza con dos baños xilol
de tres minutos cada uno
2.
Hidratación. Se realiza con etanol desde etanol
absoluto, pasando por soluciones menos concentradas hasta llegar al agua pura
de la siguiente manera: 2 baños de alcohol al 100% por tres minutos, 2 baños en
alcohol al 95% de 3 minutos cada uno, 1 baño en alcohol al 70% y un baño en
agua ordinaria, ambos por 5 minutos
3.
Tinción. El proceso varia dependiendo el
colorante que se use
4.
Deshidratación. Con concentraciones crecientes
de etanol de la siguiente manera: 1 baño en alcohol al 70% por un minuto, 2
baños en alcohol al 95% por un minuto cada uno, 2 baños en alcohol al 100% por
1 y 2 minutos respectivamente
5.
Aclaramiento. Con xilol en 2 baños de 1 y 2
minutos respectivamente.
6.
Montaje. Concluido el proceso de la tinción de
los cortes, éstos se deben colocar en condiciones de protección para poderlos
utilizar infinidad de veces sin que se deterioren, para ello se montan en
resinas naturales o sintéticas.
Existen otros procedimientos
en la técnica histológica que permiten la observación de células y tejidos en
los cuales no se utilizan colorantes. Estos procedimientos emplean sales de
metales pesados, los cuales se ponen en contacto con los componentes celulares
y tisulares a través, de sustancias reductoras u oxidantes que se depositan en
algunas de ellas (precipitación o impregnación). Al conjunto de procedimientos
se les conoce como impregnaciones metálicas.
A continuación, hablaremos de
las tinciones más utilizadas en histología y que es lo que consigue apreciarse
al observar la muestra en el microscopio. También abordaremos algunas técnicas de
impregnación metálica e inmunohistoquímica.
Tinciones Más Utilizadas
Hematoxilina-Eosina (H-E)
Esta es una tinción denominada
bicromica, ya que emplea dos colorantes: la hematoxilina y la eosina, los
cuales tiñen todos los componentes de la célula dependiendo si con basófilos o acidófilos.
La HEMATOXILINA es un colorante básico que tiñe de
color morado las estructuras ácidas de la célula, las cuales se denominan BASOFILAS,
las estructuras basófilas son: el núcleo, puesto que allí se encuentran los
ácidos nucleicos, los ribosomas y el retículo endoplásmico rugoso. Por otra parte, la EOSINA es un colorante Acido que tiñe
de color rosa las estructuras básicas de la célula denominadas ACIDOFILAS, las
cuales son: todas aquellas ubicadas en el citoplasma.
En resumen:
·
Componentes Basófilos: MORADO
·
Componentes Acidófilos: ROSA
Tinciones Tricromicas
Las tinciones Tricromicas se
llaman así porque emplean tres colorantes. Su principal objetivo es resaltar
las fibras de colágeno del tejido conectivo respecto al resto de estructuras tisulares.
Los tricrómicos contienen un colorante
nuclear y al menos dos colorantes amónicos que se utilizan en asociación con
una molécula de tipo heteropoliácido. Los dos heteropoliácidos usados en las
tinciones tricrómicas y otras tinciones histológicas son el ácido
fosfomolíbdico (PMA) y el ácido fosfotúngstico (PTA). El efecto de la
asociación entre estos dos tipos de moléculas es la coloración selectiva de las
fibras de colágeno por uno de los colorantes amónicos. Ese es precisamente el
rasgo peculiar de toda tinción tricrómica: la tinción específica de las fibras
colágenas. Además, el cartílago y algunas secreciones mucosas se tiñen del mismo
color que el colágeno, pero menos intensamente. Algunas de las tinciones tricrómicas
más usadas son: Tricromico de Gomori, Tricromico de Gallego, Tricromico de
Masson:
Tricromico de Masson
Usa un colorante
nuclear (hematoxilina férrica de Weigert),
un colorante aniónico fucsina ácida, otro colorante rojizo,
que puede ser el colorante azo ponceau 2R (también llamado
ponceau de xilidina, CI 16150) y un
colorante aniónico que tiña las fibras de colágeno,
que puede ser azul de anilina o fast green.
Las estructuras que se identifican con Tricromico de Masson son:
·
Núcleos: MORADO/CAFE
·
Citoplasma y Fibras Musculares:
ROJO
·
Fibras de Colágena: AZUL
Tricromico de Gallego
El colorante nuclear es la fucsina
acética y como colorante citoplasmático o extracelular el Picro Índigo Carmín,
que consiste en varios colorantes. Las estructuras que se identifican con
Tricromico de Gallego son:
·
Núcleos: MORADO/CAFE
·
Citoplasma y Fibras Musculares: VERDE/AMARILLO
·
Fibras de Colágena: AZUL/VERDE
 |
| Piel teñida con Tricromico de Gallego |
Tricromico de Gomori
Esta técnica combina un
colorante plasmático (cromotropo 2R) y un colorante de fibras conectivas (verde
luz/azul de anilina) en una solución de ácido fosfotúngstico y ácido acético.
Las estructuras que se identifican con Tricromico de Gomori son:
·
Núcleos: AZUL/NEGRO
·
Citoplasma y Fibras Musculares: ROJO
·
Fibras de Colágena: VERDE
| Hígado teñido con Tricromico de Gomori |
Wright y Giemsa
Es una tinción general que se
emplea mucho en hematología, ya que permite distinguir, por su coloración, los
gránulos de los diferentes leucocitos polimorfonucleares. Aunque se utiliza muy
frecuentemente en extensiones celulares, también puede usarse en cortes de
tejidos. Contiene una mezcla de colorantes catiónicos (azul de metileno, azur A
o B) y amónicos (eosina). Se emplea también en técnicas para demostrar células endocrinas.
 |
| Frotis Sanguineo teñido con Giemsa |
Papanicolau
La citología cervical es uno
de los estudios clave en el diagnostico oportuno del cáncer cervicouterino, dicho
estudio ha sido mal nombrado en múltiples ocasiones como Papanicolau, sin
embargo, lo único que lleva ese nombre es la tinción con la cual es teñida la
muestra obtenida en este estudio. Es una técnica policromica que tiene cuatro
colorantes: uno nuclear, normalmente una hematoxilina alumínica;
eosina, que tiñe de rosa los citoplasmas de las células epiteliales, los
eritrocitos, etc.; el verde brillante (light green), que tiñe el moco, y un
colorante que tiñe la queratina (Orange G).
 |
| Frotis Vaginal teñido con Papanicolau |
Impregnaciones Argénticas
Se denomina impregnación» a
toda coloración histológica en la que se emplean sales metálicas, como el
cloruro de oro (AuCl3) o el nitrato de plata (AgNO3),
para generar precipitados metálicos sobre las estructuras que se pretende
destacar.
Las técnicas de impregnación
argéntica han sido decisivas para el estudio de la organización del tejido
nervioso. Estos métodos fueron descritos por primera vez por Camillo Golgi, que
dio un gran impulso a los estudios del sistema nervioso, y fueron
perfeccionados, entre otros, por Santiago Ramón y Cajal.
En general, los protocolos de
impregnación argéntica implican dos pasos. En el primero denominado impregnación
primaria, los tejidos son expuestos a una solución ligeramente alcalina en la
que hay una concentración no muy alta de AgNO3, que proporciona
iones de plata Ag+ en exceso. El exceso de Ag+ se consigue
mediante un volumen grande de la solución de AgNO3. Los iones Ag+ generados desde estas
se relacionan con las estructuras del tejido que se va a teñir de dos maneras.
Unos pocos iones Ag+ interaccionan con las estructuras que se teñirán: estos
iones son reducidos a plata metálica en puntos muy concretos de los axones y
las dendritas. La plata reducida forma
pequeños núcleos de plata metálica invisibles al microscopio, incluso al
electrónico convencional. Estos puntos son los equivalentes a la imagen latente
que se forma en el negativo fotográfico cuando es impresionado por la luz.
En una segunda fase de los
métodos de impregnación argéntica, los cortes son tratados con una solución
similar a la que se usa para el revelado de los negativos fotográficos; es
decir, una molécula reductora, combinada con otra molécula que captura parte de
los iones de plata que se han unido débilmente al tejido. Una combinación
típica es la de hidroquinona y sulfito. El sulfito se combina con los iones Ag+
libres para formar iones [Ag (SO3)2]3_. La
hidroquinona reduce estos iones y precipita plata metálica sobre los puntos de
nucleación que se han formado en la impregnación primaria.
La impregnación argéntica se basa,
por tanto, en la interacción de determinadas estructuras del tejido con los
iones Ag+ y en la capacidad de estas estructuras de formar puntos de
nucleación de Ag° metálica.
 |
| Celulas de Golgi del cerebelo con Impregnación Argentica |
Detección de Carbohidratos
PAS
En esta técnica se utilizan
dos reactivos principales, el ácido peryódico y el reactivo de Schiff, con los
que se demuestra la presencia de un elevado número de polisacáridos. Cuando estás moléculas están presentes se tiñen de color
rosa fucsina y se dice que son PAS+, también se puede tener un efecto
similar con carmín de best y mucycarmin de Meyer.
 |
| Intestino teñido con PAS |
Detección de Ácidos Nucleicos
Feulgen
La técnica de Feulgen es un
método específico para demostrar la presencia de ADN en un tejido y también se
basa en el reactivo de Schiff. El ADN se tiñe de
color rosa fucsina
 |
| Lirio teñido con Feulgen |
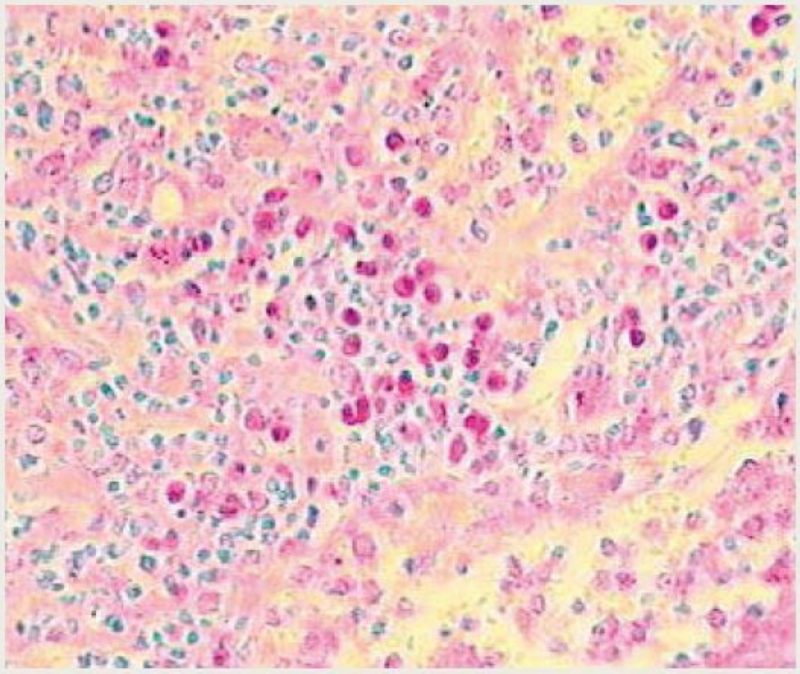
Verde Metilo-Pironina
Utiliza dos colorantes: verde
de metilo y la pironina, que tiñen, respectivamente, el ADN y el ARN. El verde de metilo es un colorante básico que, en
condiciones óptimas, es específico para el ADN (núcleo), al que tiñe de verde. La pironina tiñe el ARN (nucléolo y ribosomas en la
célula) de rojo. Controlando bien las condiciones de esta técnica,
podemos obtener un núcleo verde, mientras que el nucléolo, los ribosomas y el retículo
rugoso quedan de color rojizo
 |
Detección de Lípidos
Sudan Rojo y Negro
La tinción de lípidos con
Sudán negro se produce por un mecanismo de disolución diferencial. Puesto que
los lípidos son solubles en alcohol, ha de evitarse todo paso que requiera
alcohol (deshidratación, etc.) y por ello es preferible utilizar material congelado
o fijado en osmio. A la hora de montar la preparación, se utilizan, por el
mismo motivo, medios de montaje hidrosolubles, como el glicerol/PBS (1:1). Los lípidos
son apreciados de color negro tanto con sudan rojo como con sudan negro.
Detección de Proteínas
Inmunohistoquímica
Esta técnica utiliza un
anticuerpo contra la proteína en concreto que se desea localizar y el marcado
del anticuerpo con colorante fluorescente. Se conocen dos métodos para el
marcaje de anticuerpos el directo y el indirecto. En el método directo el
anticuerpo de la molécula se marca con un colorante fluorescente, después se
deja que este reaccione con la macromolécula que se desea localizar y se
visualiza el complejo con un microscopio de fluorescencia. En el método indirecto
primero se necesita un anticuerpo contra la molécula de interés el cual
reacciona con la molécula de interés, y luego se requiere otro anticuerpo
marcado con un colorante fluorescente contra el anticuerpo especifico,
posteriormente este reacciona y se observa el complejo al microscopio de fluorescencia.
 |
| Inmunohistoquimica metodo directo e indirecto |
 |
| Inmunohistoquimica anti-tubulina |
Identificación de Organelos
con Tinciones Subcelulares
Retículo Endoplásmico Rugoso
Se puede apreciar a través de
la tinción con azul de toluidina a través de los corpúsculos de Nissl
 |
| Corpusculos de Nissl |
Nucleolo
Se puede apreciar con azul de
toluidina, violeta de cresilo, y verde metilo-pironina
Mitocondria
En células vivas se puede
apreciar con verde Jano, y en cortes de parafina con fucsina de Altmann
Aparato de Golgi.
Fue visualizado por los primeros
neuro histólogos mediante impregnaciones argénticas 50 años antes de que se
hiciera visible mediante microscopía electrónica. En general, las técnicas consistían
en añadir al formaldehído una sustancia adicional (cloruros o nitratos) para
intensificar la argirofilia del aparato de Golgi y luego realizar una técnica
de nitrato de plata reducido sobre los cortes. La técnica argéntica modificada
de Cajal en tejidos fijados con formaldehído y cloruro de bario se utiliza para
identificar el aparato de Golgi. También se pueden emplear la técnica de Da
Fano para identificarlo.
Imagen Negativa
No todos los colorantes se
unen a las estructuras tisulares. Algunas tinciones se basan en la exclusión de
la coloración. La imagen negativa consiste en teñir todo menos la estructura que
queremos visualizar. Es decir, se trata de una tinción basada en las
estructuras que no son teñidas por el colorante. Un ejemplo es con la técnica de
Da Fano que permite apreciar al Núcleo por imagen negativa.
En resumen, la técnica histológica
nos permite preservar las muestras de tejidos para su estudio a detalle en el
microscopio, a quien dedicaremos nuestra siguiente entrega para hablar de los
sistemas de microscopia óptica y electrónica.



